文献解读|Elabscience助力客户发表“双锁纳米颗粒优化癌症免疫治疗”研究成果
Source: Elabscience®Published: 2021-05-31
内容预览
刘阳研究员和史林启教授团队研究开发了一种能限制CRISPR/Cas13a系统仅在肿瘤组织中激活的双锁纳米粒子(DLNP),且在血液循环和正常组织中具较好的循环稳定性。DLNP到达肿瘤微环境后,能增强CRISPR/Cas13a系统聚集并激活其在肿瘤位点的基因编辑效应,这种精准控制能够使CRISPR/Cas13a系统更有效的应用于癌症治疗中。
祝贺两位教授及其团队在顶级期刊Advanced Materials发表突破性研究成果!很荣幸Elabscience®的产品能够为这一伟大的科研成果贡献自己的一份力量。

基本信息
文章标题:Dual-Locking Nanoparticles Disrupt the PD-1/PD-L1 Pathway for Effcient Cancer Immunotherapy
中文标题:双锁纳米颗粒干扰PD-1/PD-L1通路,用于有效癌症免疫治疗
期刊:Advanced Materials
IF:25.809(2019)
第一作者单位:南开大学
通讯作者单位:南开大学
使用Elabscience®产品:


研究背景
癌症的特征是多种遗传改变或突变导致异常代谢和增殖的细胞行为。药物代谢过程中的遗传改变和靶向通路中的遗传修复促进肿瘤细胞对传统疗法的耐受性。最近,一种新型的簇状规则间隔短回文重复序列(CRISPR)/CRISPR相关酶(Cas),即 Cas13a(前称C2c2),被鉴定为RNA导向的靶向RNA的CRISPR效应因子。 Cas13a / CRISPR RNA(crRNA)复合物在与靶标RNA结合后激活一般的RNase活性,引发细胞RNA的非特异性裂解,并最终导致程序性细胞死亡或休眠(这种伴随的生物化学现象也称“附带效应”)。这种独特的“附带效应”自动绕过了实体瘤对传统疗法的复杂耐受性和逃逸机制,从而使CRISPR / Cas13a系统成为癌症治疗的理想治疗剂,具有降低有效剂量和使耐受性最小化的潜能。
但是,这种“附带效应”并不是特异性针对肿瘤细胞的,任何细胞的RNA与Cas13a/crRNA复合物互补结合时,它就可以被激活。以程序性死亡配体1(PD-L1)为例。PD-L1在很多恶性肿瘤中过表达并与其受体PD-1结合,从而使T细胞失活。通过“附带效应”清除PD-L1阳性的癌细胞,能够重新激活T细胞并增强其介导的抗肿瘤的免疫应答。然而,PD-L1作为关键的抑制分子,在一些免疫细胞和组织细胞中也有表达。当全身都施用基于Cas13a/PD-L1系统的药物时,可能会导致肿瘤以外组织中不期望的细胞死亡的安全性问题。因此,仅在肿瘤细胞中限制CRISPR / Cas13a系统激活的可行性策略对于基于CRISPR/ Cas13a的药物在癌症治疗中的安全应用至关重要。
为了达到对体内Cas13a/crRNA系统激活的精准控制,将基于Cas13a/crRNA系统的药物特异性传送至肿瘤组织是十分关键的。肿瘤微环境(TME),特别是酸性微环境(pHe),是实体肿瘤的典型特征之一。基于这种特征,几种用于传递CRISPR系统的pH响应型非病毒载体(包括无机的和化合的纳米粒)已开发成功。然而,酸性细胞器或其他外部来源的酸积累也可以激活CRISPR/ Cas13a。因此,更加精准控制的CRISPR/ Cas13a激活策略要求不能仅依赖于酸性微环境来达到有效载荷释放。活性氧(ROS) ,特别是过氧化氢(H2O2)的过度释放,是肿瘤的另一个特征,不仅在肿瘤发生的过程中起重要作用,而且还影响细胞DNA突变和肿瘤发展。结合pHe和H2O2可以有效区分肿瘤和正常组织。因此,释放有效载荷的载体同时对pHe和H2O2浓度进行响应,将会是一种传递CRISPR/ Cas13a系统的理想平台,还可能对CRISPR/ Cas13a激活形成一种新型控制。
实验思路和设计
开发一种可以限制CRISPR/ Cas13a激活至肿瘤组织的双锁纳米颗粒(Dual-Locking Nanoparticle, DLNP),并验证其pH和H2O2双响应性。
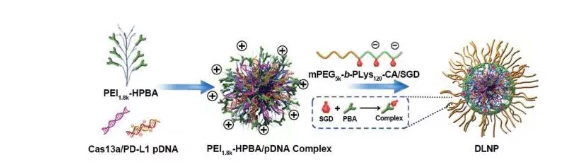
选择靶向PD-L1基因的crRNA作为模型crRNA,验证体内体外DLNP, H2O2-NP和pH-NP作为CRISPR/Cas13a释放平台的抗肿瘤机制及其有效性。
重要研究成果
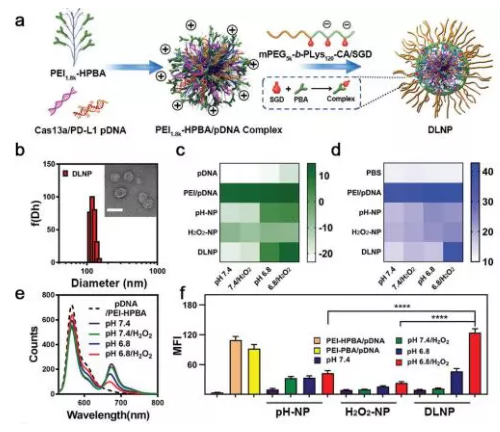
1.DLNP, H2O2-NP和pH-NP的结构特征。通过两步法制备DLNP,编码CRISPR/Cas13a系统的pDNA被负载在纳米粒子的核内,并由pH和H2O2双响应的聚合物壳层所包裹。研究人员通过zeta电位,表面非特意性蛋白吸附,荧光能量共振转移以及细胞摄取等实验,证明了双锁纳米粒子的pH和H2O2双特异性。

2.DLNP用于有效癌症免疫治疗过程。与双锁保险箱仅在同时打开两个锁时才能解锁的原理类似,DLNP只能在低pHe和高H2O2的微环境下才释放CRISPR/Cas13a系统。基于PD-1/PD-L1靶向通路的CRISPR/Cas13a系统,DLNP能高效导向T细胞介导的抗肿瘤免疫应答并重塑之后的免疫抑制肿瘤微环境,显著提高抗肿瘤效果及生存率,且副作用极小。
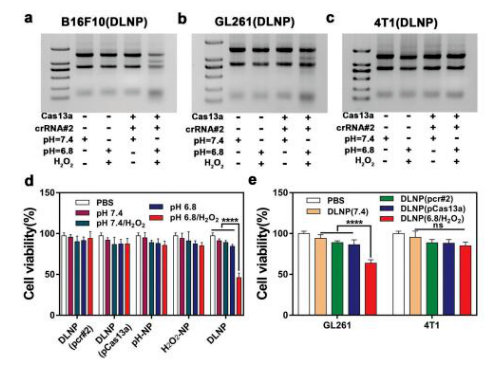
3.DLNP, H2O2-NP和pH-NP的生物功能特征。选择靶向PD-L1基因的crRNA作为模型crRNA,经DLNP处理的B16F10(图a),GL261(图b)细胞RNA在pH6.8/H2O2条件下呈现相似的裂解趋势,而DLNP处理的4T1细胞未观察到RNA裂解(图c),表明DLNP诱导RNA裂解时TME和PD-L1的双重特异性,进一步的细胞活性验证实验也支持这一结果(图d, e)。
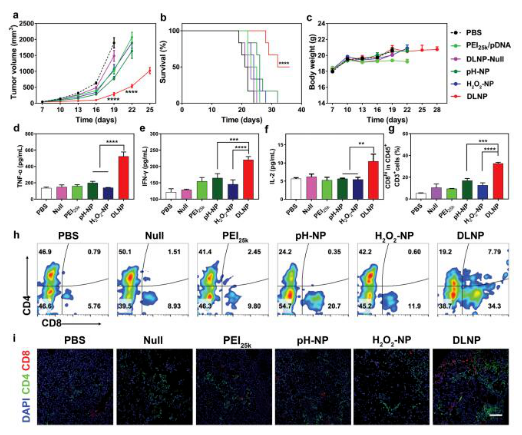
4.DLNP体内抗癌效用。H2O2-NP和pH-NP两种纳米粒子基本没有明显的抑瘤效果,而DLNP能明显抑制小鼠肿瘤生长并能显著提高患癌小鼠存活率(图a, b),体重也没有明显的减少(图c),同时提高IFN-γ, TNF-α, IL-2水平(图d, e, f)并有效提高肿瘤内CD8+ T细胞的渗透(图g, h, i)。表明DLNP可以干扰PD-1/PD-L1通路,恢复T细胞介导的抗肿瘤免疫。
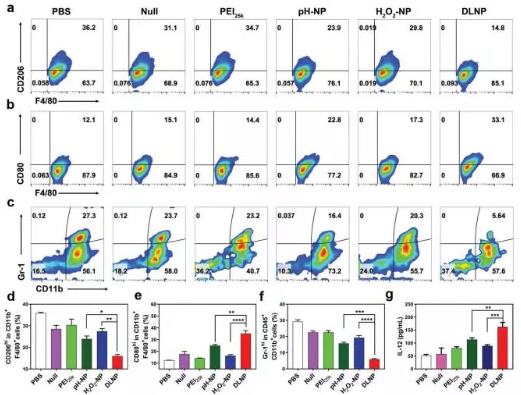
5.DLNP在TME中的免疫应答分析。 研究发现,DLNP导致M2/M1的两极分化效应,经DLNP处理的患瘤小鼠体内观察到M2样TAMs(CD206hiCD11b+F4/80+)明显减少而M1样TAMs(CD80hiCD11b+F4/80+)则显著增加(图a, b, d, e, g)。另外,还观察到DLNP能显著减少TME中MDSCs(图c, f)。这些结果表明DLNP可以显著减少TME中T细胞消耗,并恢复T细胞抗肿瘤免疫。
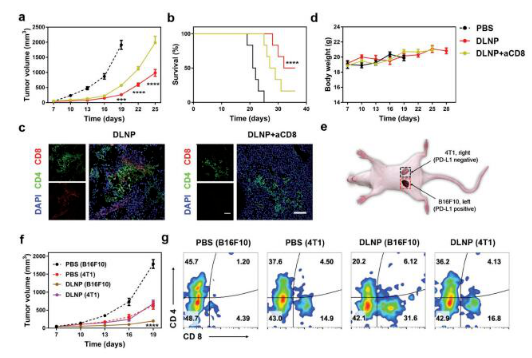
6.体内分析DLNP在CD8+ T细胞阻断B16F10和4T1/ B16F10共存小鼠模型的抗肿瘤作用。研究结果表明,CD8+ T细胞阻断的小鼠模型中,DLNP的抑瘤效果和小鼠的生存率明显下降(图a, b, c),表明CD8+ T细胞在抑制肿瘤生长方面起重要作用。对4T1/ B16F10共存小鼠模型进行分析发现DLNP可以选择性抑制高表达PD-L1(B16F10细胞)肿瘤细胞的生长而对低表达PD-L1(4T1细胞)无明显的抑制作用(图e, f, g)。结果表明,DLNP在助力基于CRISPR/Cas13a的新型免疫疗法的发展方面具有很大的潜力。
文章创新点
1.本研究开发了一种能限制CRISPR/Cas13a系统仅在肿瘤组织中激活的双锁纳米粒子(DLNP),且在血液循环和正常组织中具较好的循环稳定性。DLNP到达肿瘤微环境后,能增强CRISPR/Cas13a系统聚集并激活其在肿瘤位点的基因编辑效应,这种精准控制能够使CRISPR/Cas13a系统更有效的应用于癌症治疗中。
2.选择PD-L1基因作为模型crRNA,在体内体外验证DLNP/Cas13a/PD-L1能够特异性抑制PD-L1高表达的肿瘤生长并提高存活率,且无明显的副作用。考虑到免疫效应细胞抑制途径的多样性,可以通过替换特异性crRNA的靶向基因,进行后续的相关研究和开发,可能使DLNP成为快速开发安全有效的癌症免疫疗法的通用平台。






