WB实验背景很脏是什么原因?该如何解决?
Source: Elabscience®Published: 2019-02-27
Western Blot实验可以说是生物专业最基础的实验了,然而,虽然WB实验天天做,但是正常高清的结果图并不是你想有就能有。
WB实验出现最多问题的,应该就是各种背景问题了。
你想一下,好不容易实验过五关斩六将做到最后一步,扫描结果出了,是这样的:
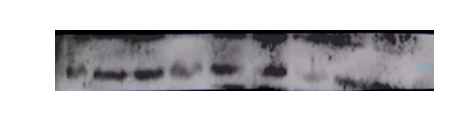
为什么明明跑出了想要的趋势,但就是背景脏?怎么让自己的条带不因脏脏的背景而毁了呢?
这里要清楚一点,背景脏不一定是因为仪器不干净造成的,也有可能是蛋白降解或者整个实验过程中条件不合适造成的,有可能是以下的环节出了问题:
1、实验准备
提取蛋白所需的研磨器材,以及制胶的玻璃板、梳子要清洗干净;
若长期不使用,建议器材在实验前再行清洗一次以杜绝相应的污染。
2、提取蛋白
选择合适的蛋白裂解液,充分去除一些干扰因素,比如核酸,多糖,脂类等;
建议蛋白在测量浓度后变性分装保存,避免反复冻融使蛋白发生降解;
注意Loading buffer在保质期内,蛋白加入Loading buffer后充分混匀,再煮沸变性。
3、制胶
玻璃板夹紧之后,有些人习惯性加水试一下是否漏胶,建议用蒸馏水而不是自来水测试,测试结束后要将玻璃板之间的水倒干净,用滤纸吸干残留的水;
灌胶之前要将配好的试剂充分混匀,灌胶的过程中要掌握好速度,缓慢加入,避免产生气泡;
灌注好分离胶后,缓缓加入无水乙醇封胶,该步操作时速度一定要慢,防止胶面被冲变形;在等待分离胶凝固的过程中,不要总去摇晃观察;
温度较高的情况下,30min左右就会凝固,冬天气温较低可能需要较长时间;
若分离胶液面不平,会影响后期蛋白电泳的效果。
4、转膜
转膜前需在转膜板两侧各放置3-4张滤纸(两侧数量相同);
切记不要用手直接接触PVDF膜和滤纸,手上的油脂会对其造成污染,务必佩戴干净的手套,全程尽量使用镊子夹取;
转膜过程中海绵-滤纸-凝胶-PVDF膜-滤纸-海绵每一层的气泡要排空;
转膜时要使整个电转仪置于冰水混合物中,常用220V或者其他高电压进行;
机器温度升高,会使蛋白降解,也就是转膜后,用丽春红染色发现条带跑糊,发光后条带和背景也会脏的一塌糊涂。
5、孵育抗体
孵育一抗的时间大多会选择4℃过夜,也可以室温封闭2小时,4℃过夜效果会比室温好,4℃过夜具体多长时间算合适,其实没有硬性规定;
二抗孵育的时间不宜过长,一般是室温下摇床孵育1~2小时,抗体孵育完成后要清洗干净,特别是二抗孵育完成后,否则可能导致显影结果出现高背景。
6、发光液配置
大部分实验室使用的ECL发光液,A液和B液按照1:1的比例配置;
发光液要求现用现配,每次根据使用量合理配置用液量;
发光液配置时间过长同样会引起发光效果不好,背景脏或者漆黑一片。
有没有更好的方法,让WB实验不再出那么多问题?
推荐使用——WB试剂盒
各位同学,做WB实验时,除了担心结果出问题之外,你是不是也经常要花很多时间和精力去对比购买的各种试剂?并且每个试剂均需单独配制、调整配比、验证可用性?
而且,经常买了很多试剂但是一次也用不完,还造成浪费,实验效率也很低下,人为差异性极易造成结果的不准确。
WB实验怎样才能更快更好的做完呢?你可以试试这款Western Blot试剂盒,这个试剂盒里面就是包含了Western
Blot整个实验所需的全套试剂,再也不用单独一个个去购买了。![]() 货号:E-IR-R304
货号:E-IR-R304
并且,这款试剂盒内的各种试剂均已配好,不需要单独调整配比!检测灵敏度高,实验结果非常的客观准确;
还有重要的一点,就是非常省钱哦~一个试剂盒可供完成5块凝胶(约50个样)对应的Western Blot实验,再也无试剂的浪费了;
最后,根据待检测蛋白分子量大小,还可灵活选择不同规格的WB试剂盒,相当贴心了。
用了这个WB试剂盒,跑出来的图是这样的:
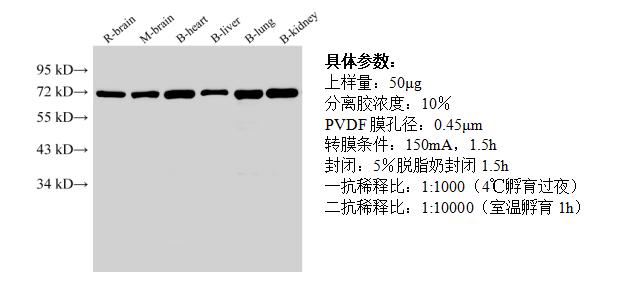
怎么样?是不是很清晰?
WB实验背景很脏的问题,你解决了没?






