Rt-qPCR如何高效准确加样
Source: Elabscience®Published: 2022-12-14
Rt-qPCR(实时荧光定量PCR)是分子生物学的基础实验,主要包括三大步骤:RNA提取、逆转录成cDNA、实时荧光定量PCR。虽然看起来逆转录实验只是将几种试剂加在离心管中混匀,进行反应即可,但在实际操作过程中,还有许多细节需要注意。
根据其化学原理不同,Rt-qPCR可以分为2种检测方法:一种为探针法,如TaqMan探针法;一种为染料法,如SYBR Green Ⅰ染料法。今天来给大家分享一下做Rt-qPCR实验(SYBR染料法)时的加样心得,助力大家在做Rt-qPCR实验时,加样高效又准确!
01 上样前的点样规划
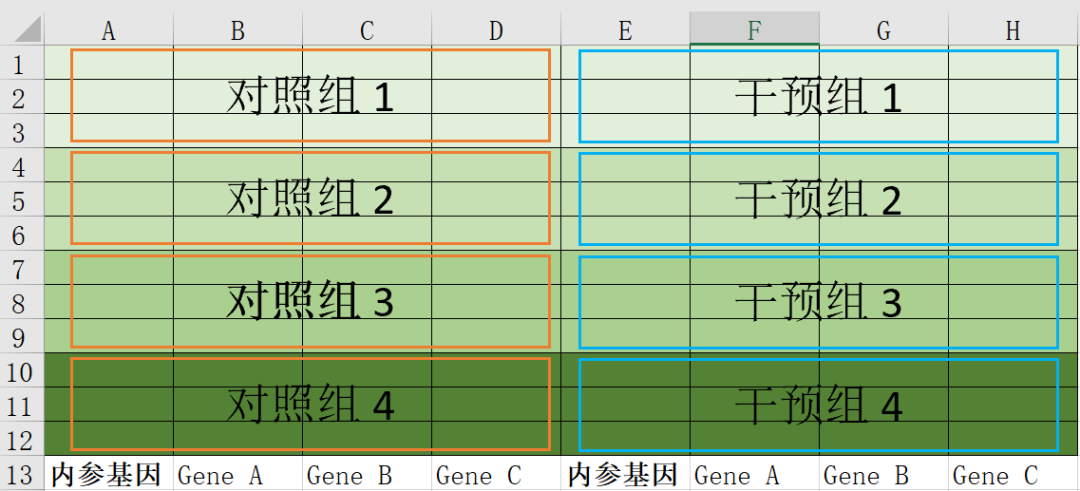
首先,根据实验需要进行96孔板孔位规划,实验需要满足3个技术重复及至少3个生物学重复。
假设一次实验需要检测8个样品中3种目的基因表达,则需要的孔位数为:
8(样品数)×4(目的基因数+内参基因)×3(三个技术重复)=96。
如下图所示96孔板示意图(从上到下依次为A-H,从左到右依次为1-12),每个大方框(橙色/蓝色)内是同一种cDNA,A列及E列均加上内参基因的引物。3种目的基因(如基因A、B、C)分别按如下分布:
02准备试剂和样品
将Rt-qPCR所需要的试剂如:无酶水,SYBR,上下游引物等以及样品(cDNA)置于冰上备用。
03混合无酶水、SYBR、上下游引物
根据以上点样规划,计算每种引物所在位置孔位数,如内参基因为A列及E列上样,需要加24个孔,一般配Mix时需要多配2个孔,我们按26个孔的量,除cDNA(1μL)后需配置余下体系。
准备一个EP管,按照试剂盒提示(此为takara试剂盒上样体系,共计20μL)分别计算:
无酶水:7.4μL×26=192.4μL
SYBR:10μL×26=260μL
上下游引物各:0.8μL×26=20.8μL
26个孔混合物的总量:19μL×26=494μL=260μL+20.8×2μL+192.4μL
充分混合均匀,置冰上备用。按照同样的方法分别配置含有目的基因的混合物。
04 上样
第一次上样:将上述混合物按照点样规划加入相应孔位,例如A列及E列均加含有内参基因的混合物,每孔19μL。
Tips:每次加入小孔底部,不用更换枪头,加含有另一种引物的混合物时再更换。
第二次上样:每孔加入1μL cDNA。
Tips:为了避免污染,每次需更换枪头。
为了提高上样准确性,周老师教大家2个上样小妙招:
① 首先,根据实验需要进行96孔板孔位规划,实验需要满足3个技术重复及至少3个生物学重复。
② 准备好一个完整的无酶10μL枪头盒,对应好96孔板位置取用枪头,避免上样失误。
05上机
上样完成后,贴好封板膜,离心(一定要记得离心!!!否则上机后没有底物不反应或混合不均实验差异大),使体系全部混合后再上机。如果因不可抗力不能及时上机,需将96孔板置于4℃避光保存(亲测4℃放置4h左右再上机也不影响结果)。
以上是跟大家分享的Rt-qPCR实验的加样技巧,希望帮助大家更顺利的完成实验~






