Annexin V的常见问题分析及解决方案
Source: Elabscience®Published: 2024-02-07
Annexin V染色法是检测细胞凋亡的方法之一。我们常将荧光染料标记的 Annexin V与Propidium iodide(PI)/7-AAD/DAPI搭配使用,通过流式细胞仪区分正常细胞、凋亡早期和凋亡晚期细胞。
本期流式课堂,带大家一起分析总结Annexin V实验中常见的失败原因和优化方案,快来看看有没有你遇到的问题呢?
1.细胞碎片比例过高
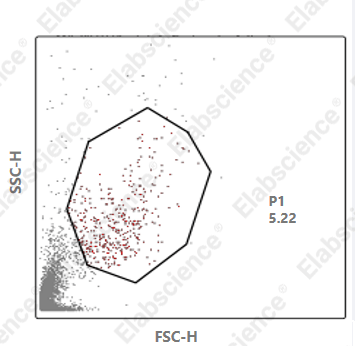
|
可能原因 |
解决方案 |
|
胰酶消化过度 |
待大部分细胞开始皱缩变圆、细胞间隙增大时,及时加含血清的培养基终止消化;部分难消化下来的细胞可分批多次消化 |
|
Annexin V Binding Buffer(10×)未稀释 |
重新配制1×Annexin V Binding Buffer |
|
细胞本身状态不佳 |
优化细胞培养条件,调整细胞状态 |
|
实验操作带来的机械损伤 |
温柔处理细胞。避免移液器直接接触细胞;注意离心“缓升缓降”等 |
2.空白组有荧光信号
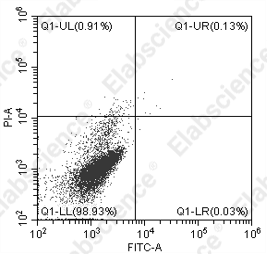
|
可能原因 |
解决方案 |
|
流式细胞仪没有清洗干净 |
仪器重新清洗质检 |
|
细胞不纯 |
通过相关技术鉴定,分析样本中是否混有其他细胞 |
|
凋亡或坏死细胞的本底荧光 |
优化细胞培养和收集等步骤降低对细胞的损伤 |
3.正常细胞出现大量凋亡
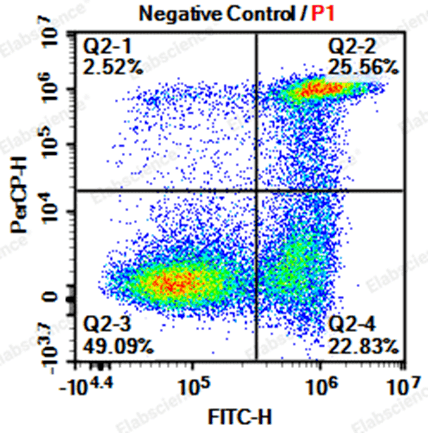
|
可能原因 |
解决方案 |
|
细胞状态不佳 |
调整细胞状态,重新培养细胞 |
|
实验操作带来的机械损伤,或细胞消化过度 |
温柔处理细胞 |
|
染色时间过长(细胞长时间处于非正常生长环境会导致细胞凋亡) |
控制好实验时间,如果样本太多,可以分批进行实验 |
|
Annexin V Binding Buffer(10×)未正确稀释 |
重新配制1×Annexin V Binding Buffer |
4.缺少早期凋亡
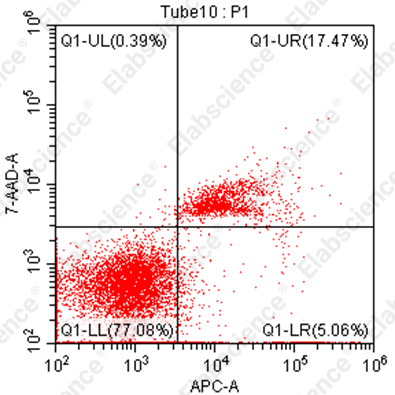
|
可能原因 |
解决方案 |
|
药物处理或加入溶剂浓度过高,或加入药物未及时混匀导致局部浓度过高,使部分细胞出现被固定的效果,改变了细胞膜通透性 |
调整加药方式和浓度 |
|
药物处理时间过长,药物浓度偏低(耐药强的细胞基本不受影响,不耐药的细胞进入凋亡晚期或被破坏成为裸核形态) |
缩短药物诱导时间,适当提高加药浓度 |
5.缺少晚期凋亡
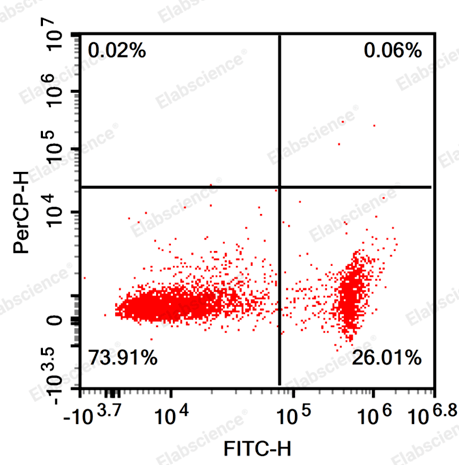
|
可能原因 |
解决方案 |
|
核染料忘记添加 |
重新实验,注意添加核染料 |
|
细胞确实没有晚凋和裸核 |
重新调整细胞处理条件,可以借助显微镜观察细胞是否凋亡 |
|
阈值设置过大,没有收集到凋亡信号 |
调整仪器设置,降低阈值 |
|
贴壁细胞培养上清中的细胞没有收集 |
收集上清中的细胞 |
6.分群不明显
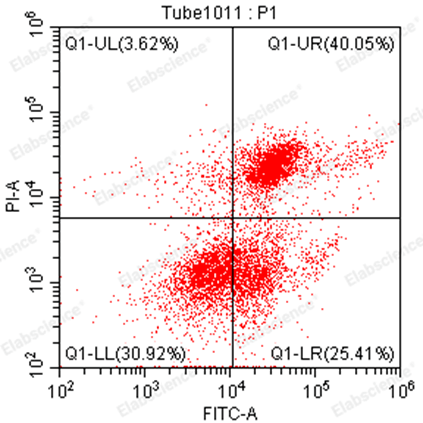
|
可能原因 |
解决方案 |
|
荧光物质干扰(如:转染、药物、细胞本底荧光) |
优先选择调整补偿,如果难以调节,建议更换其他荧光标记的试剂盒,或者用其他物质处理细胞 |
|
细胞状态较差,所有细胞都有一定的PS外翻 |
培养、实验过程都需要温柔对待细胞 |
|
细胞数量太多,染料相对不足 |
按照孵育体系处理样本 |
7.处理组凋亡率过低(小于10%)
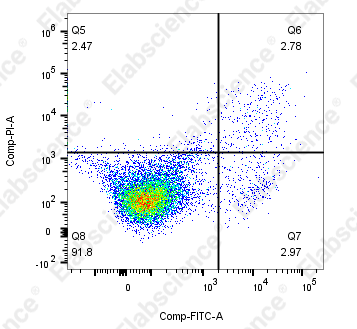
|
可能原因 |
解决方案 |
|
细胞本身凋亡率低 |
重新优化凋亡诱导实验 |
|
未收集细胞上清 |
重新收集细胞 |
|
胰酶中的EDTA影响Annexin V与PS的结合 |
使用PBS将细胞清洗干净 |
|
染料孵育时间不足 |
严格按照说明书孵育时间处理 |
|
未圈到凋亡细胞群 |
正确圈门 |
8.实验组中存在斜向上的细胞群
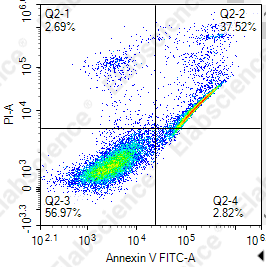
|
可能原因 |
解决方案 |
|
荧光染料间的补偿调节不合适 |
建议做单染管,调节补偿。 |
|
荧光物质干扰(如:转染、药物、细胞本底荧光) |
优先选择调整补偿,如果难以调节,建议更换其他荧光标记的试剂盒,或者用其他物质处理细胞 |






