TUNEL常见问题及解决方案
Source: Elabscience®Published: 2023-04-11
细胞凋亡属于程序性细胞死亡的一种,是受到特定基因调控后的主动性死亡过程,也是正常的细胞生理应答反应。在细胞凋亡晚期时,DNA会发生片段化,双链断裂,从而暴露出大量的3'-OH粘性末端,在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-末端,通过荧光显微镜或流式细胞仪进行检测,这类方法称为TUNEL法(TdT-mediated dUTP Nick-End Labeling)。由于正常的或正在增殖的细胞几乎没有DNA的断裂,没有3'-OH形成,因而不被染色。由此,TUNEL成为了细胞凋亡检测的最常用方法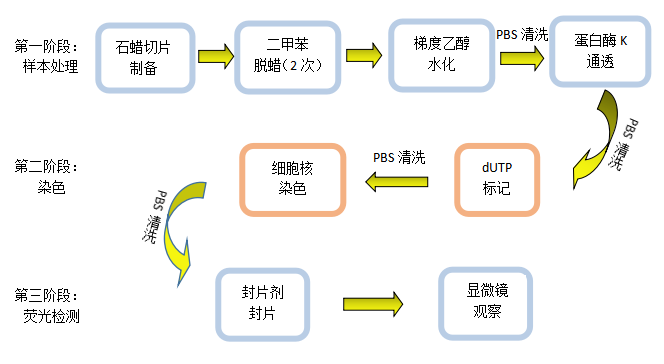
TUNEL染色实验步骤
在进行TUNEL实验时,常常会遇到染色结果异常的情况,如荧光信号弱或没有荧光信号、非特异性染色、荧光背景太强等问题。那导致这些问题的原因是什么呢?我们应该如何避免这类问题的产生呢?本篇文章将为大家解答以上疑惑。
01.荧光信号弱或没有荧光信号
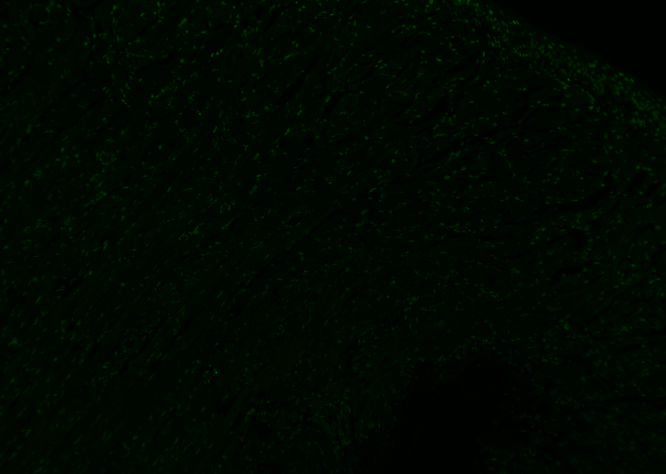
细胞或者组织样本明明是处于凋亡状态,但是用TUNEL试剂盒检测发现荧光信号偏弱或没有信号
1 固定剂与固定时间不合适。注:如果用乙醇或甲醇固定的样本,则会导致标记效率较低,因为在固定时染色质未能与蛋白质交联,从而导致染色质在操作中丢失。
答:固定剂建议使用溶于PBS PH7.4中的4%多聚甲醛固定或福尔马林或戊二醛固定。当然,固定时间要合适,时间过短,固定不充分,时间过长,会导致染色质与蛋白质交联程度过高,不利于dUTP与染色质的结合。
2 脱蜡和水化不充分。
答:脱蜡时先以60 C烤片30 min,再浸入二甲苯两次中,每次10 min;水化用梯度乙醇从高到低浓度浸洗。
3 通透效果不佳。
答:根据切片的厚薄,选择蛋白酶k的孵育时间,常用10~30 min,通过摸索达到既不会脱片,又能够使酶和抗体进入细胞内。若处理时间过短,细胞通透不彻底,试剂不能到达靶分子或浓度过低。
4 荧光淬灭。
答:Fluorescence在普通光照10分钟就会严重淬灭,建议标记与检测样本时,载玻片要避光,实验结束后要尽快观察。若需要暂时储存,建议4C条件避光保存,且保存时间不超过一个月为宜。
5 凋亡诱导条件不合适。
答:用紫外或者红外诱导的细胞的凋亡,DNA不断裂,无法检测到晚凋信号,可以选择其它检测方法。
2 非特异性染色(假阳性高)
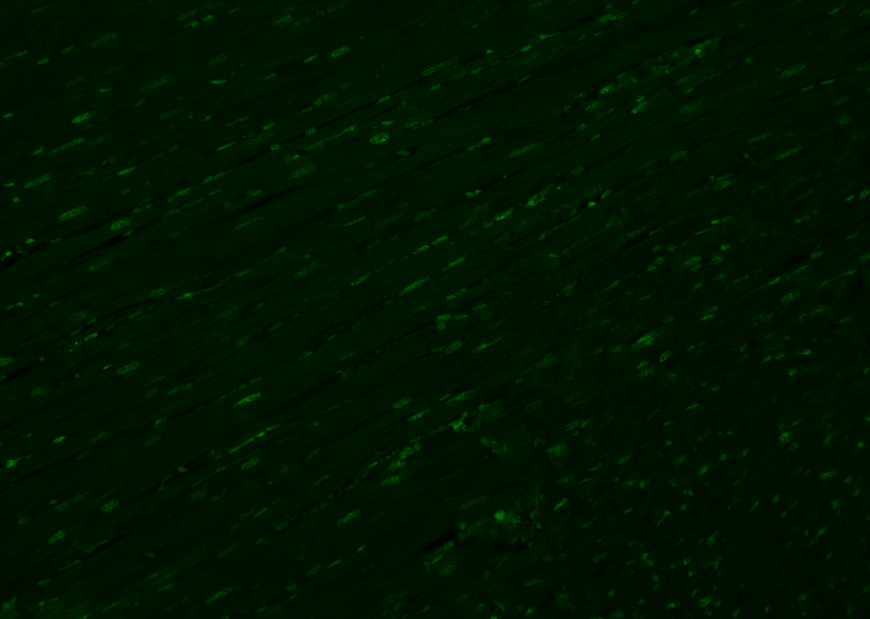
细胞或者组织样本明明是未做任何处理的活细胞,但是用TUNEL试剂盒检测,出现了非特异性染色,和处理过的荧光信号一样强,甚至比阳性对照组荧光信号还要强。
原因1:有些细胞或组织,例如平滑肌细胞或组织中,nuclease或polymerase的酶活性水平较高,容易导致出现假阳性信号。取细胞或组织后立即固定并且要充分固定,以阻止这些酶导致假阳性。
原因2:使用了不合适的固定液,例如一些酸性固定液,导致出现假阳性。建议采用推荐的固定液。
原因3:细胞固定时间过长。固定时间过长导致细胞自溶,从而出现假阳性,建议控制好固定时间。
原因4:TdT酶反应时间过长或TdT酶反应过程中反应液渗漏,细胞或组织表面没保持湿润。注意控制好反应时间,并确保TdT酶反应液能很好地覆盖样品。
原因5:工作液孵育时间过长或者未清洗干净。控制好工作液孵育时间,并在孵育完成后将工作液清洗干净。
需要注意:在坏死的晚期阶段或在高度增殖/代谢的组织细胞中也会产生大量DNA片断,从而引起假阳性结果。
3 荧光背景强
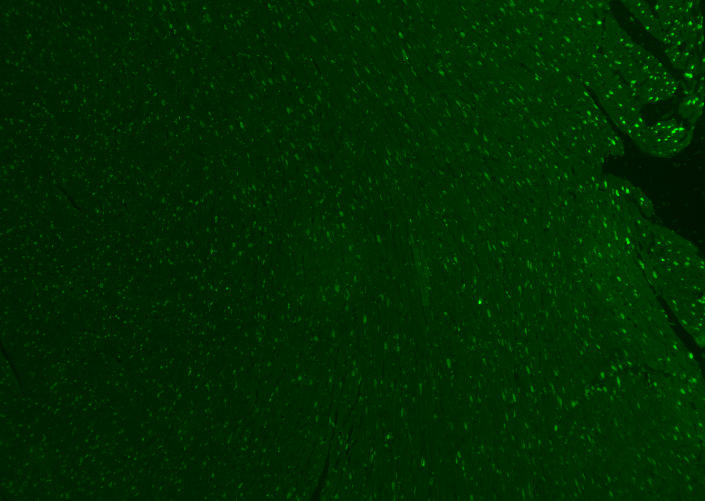
背景染色太强是指除了我们想看到的特异性染色外,还有与我们想看到的特异性染色颜色相同的荧光信号干扰我们的实验结果。
Q:TUNEL染色时间过长。
A:建议染色时间适当,一般是 37 C 孵育60 min。
Q:PBS漂洗不足。
A:酶或者荧光标记工作液反应完后PBS漂洗不足,会导致残留。如果背景较高,可增加漂洗次数,清洗不彻底会导致切片的非特异性着色。
Q:曝光时间过长。
A:调整曝光条件,先对阴性组调整到无背景光,然后用相同的曝光条件拍摄实验组。
以上给大家列举了部分TUNEL实验中常见的问题和解决办法。当然,想要实验路上少走弯路,除了完美避坑,还要注意对照的设置,如阳性对照和阴性对照设置。设置对照除了能证明试验的客观性及准确性,还能在出现问题时,帮助我们快速查找原因,节约实验时间。本期的TUNEL讲解就到这里结束了,更多TUNEL实验相关信息,详见伊莱瑞特官网内容《TUNEL检测细胞凋亡原则及经验总结》






