文献速递|癌症免疫疗法新思路!
Source: Elabscience®Published: 2019-11-26
基本信息:
文章标题:NIR/ROS-Responsive Black Phosphorus QD Vesicles as Immunoadjuvant Carrier for Specifc Cancer Photodynamic Immunotherapy
中文标题:NIR/ROS响应型黑磷量子点囊泡可作为特异性癌症光动力免疫疗法的免疫佐剂载体
期刊:Advanced Functional Materials
IF:15.621(2018)
第一作者单位:福州大学
通讯作者单位:福州大学
使用的Elabscience产品:
|
产品货号 |
应用 |
检测靶标 |
种属 |
测定样本 |
|
ELISA |
白介素6(IL-6) |
小鼠 |
血清 |
|
|
E-EL-M3063 |
ELISA |
肿瘤坏死因子α(TNF-α) |
小鼠 |
血清 |
|
E-EL-M3062 |
ELISA |
白介素12(IL-12) |
小鼠 |
血清 |


研究背景:
2D黑磷纳米片和量子点作为两种主要的黑磷材料,广泛应用于生物医学领域。然而,很少有刺激响应型纳米载体满足纳米医学需求的相关研究报道。
黑磷(BP)是一种无金属层状半导体,其在近红外区域(NIR)具有的独特光学特性和卓越的生物相容性,使得其具有多种生物医学用途。研究测定结果表明,黑磷量子点(BPQDs)或其纳米晶体可作为光声成像(Photoacoustic (PA) imaging)及抗癌的光热治疗(PTT)和光动力治疗(PDT)的辅助治疗试剂。因其依赖于层的可调谐的直接带隙及高载流子迁移率,BPQDs能产生大量的活性氧,可作为一种十分有效的PDT治疗药物诱导癌细胞凋亡。然而,因其快速清除率及缺乏多用途性,BPQDs在临床上的应用受到很大的限制。BPQDs的超小型尺寸导致其在组织中被快速清除,呈现出较低的治疗效果。其次,BPQDs缺乏多样性功能,使其在如免疫治疗等新型疗法中应用失败。因此,有必要增加BPQDs的尺寸并开发新型、多功能的纳米治疗平台,以应用于更先进的抗癌疗法。
不同于传统的手术治疗、化疗、放疗等方式,癌症免疫疗法增强了肿瘤的免疫原性并激活宿主抗肿瘤免疫应答,进而抑制肿瘤细胞增殖。免疫治疗策略因其极具前景的临床前研究结果,如免疫检查点阻断、原位免疫原性细胞死亡(Immunogenic Cell Death, ICD)诱导模型等,在近年来已获得极大的关注和重视。ICD治疗策略中,坏死的肿瘤细胞可发挥“疫苗”作用,吸引抗原呈递细胞(Antigen Presenting Cells, APCs)向天然T细胞呈递肿瘤相关抗原。这一机制使细胞毒性T细胞激活并集聚到肿瘤组织中,引发针对残留肿瘤细胞的协同免疫应答。光动力免疫治疗(PDT)是一种新型的免疫治疗模式,非损伤性PDT能引发ICD,从而激发协同的抗肿瘤免疫应答并直接杀死肿瘤细胞,且对正常组织仅产生极小的损伤。然而,由于效果不佳的免疫佐剂只能引发较弱的免疫应答,在免疫治疗中达不到令人满意的疗效。CpG寡聚脱氧核苷酸(CpG oligodeoxynucleotides, CpG ODNs)是一种能增强APCs的细胞因子分泌的有效佐剂,并在Ⅰ-Ⅲ期临床试验中表现极佳。但是,单纯的ODNs在体循环中会被快速清除,因此需要开发出一种合适的载体能将CpG ODNs有效递送给APCs。
实验思路:
制备一种新型的NIR/ROS敏感型BPQD纳米囊泡(BPNVs)来封装CpG(见下图),试图提出一种强有效的光动力免疫治疗策略来抑制肿瘤生长
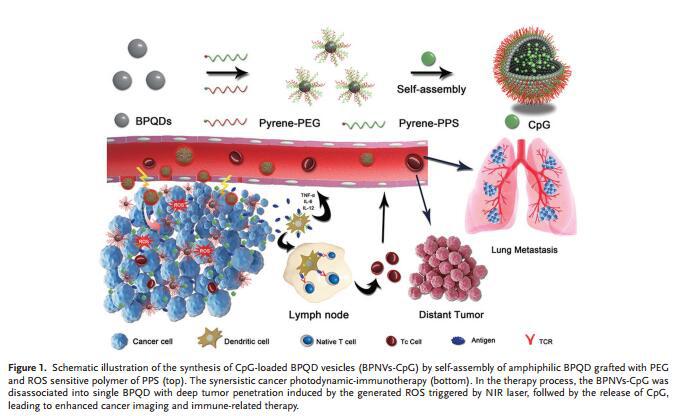
图示BPNVs-CpG制备过程(上部)及协同的癌症光动力免疫治疗(下部)。
封装的CpG在小鼠体内释放进肿瘤组织中并与肿瘤抗原一起被APCs捕获,刺激APCs分泌多种功能的细胞因子,从而增强抗肿瘤免疫应答
实验设计:
Ø制备NIR/ROS响应型BPQD多聚物囊泡(BPNVs),测定其光学性能并与BPQDs进行比较
Ø通过活死细胞染色、细胞凋亡实验、激光扫描等手段体外测定BPNVs介导的细胞毒性
Ø通过TUNEL、电镜观察等实验手段验证BPNVs-CpG在体外潜在的抗癌治疗机制
Ø 4T1肿瘤模型小鼠注射BPNVs-CpG聚合物,并设置多个实验组,验证BPNVs-CpG在体内的抗癌免疫治疗效果及其抗癌机制
重要研究成果:

BPNVs-CpG表现出球形纳米结构,这种中空的囊泡结构非常适用于生物医学用途(图a, b,c),与BPQDs相比,BPNVs-CpG在680nm激光刺激的PA信号更强(图f),表明其高度适用于生物成像。ROS响应型BPNVs在近红外激光照射下逐渐解离(图g, h, i),这种特质能满足靶向免疫治疗中CpG的远程释放需求。

体外验证BPNVs介导4T1和MCF-7细胞毒性,无NIR照射时,两种细胞的细胞摄入率及存活率都相当高,NIR照射时,细胞的死亡率与BPNVs剂量正相关(图a,b),表明BPNVs介导的细胞毒性低并具刺激响应型光动力活性。另外,BPNVs在体外还能引发PDT效应,NIR照射时,肿瘤细胞凋亡率高达40.98%(图c, d)。
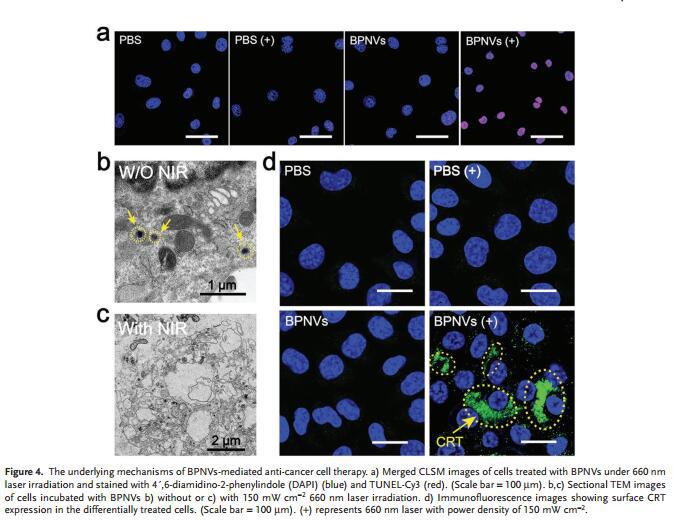
BPNVs/660nm激光照射处理可引发癌细胞大量凋亡,表明BPNVs能为PDT提供胞内ROS(图a),同时观察到细胞表面的CRT蛋白大量表达(图d),表明BPNVs具有诱导ICD的潜在能力,激发强烈的抗肿瘤免疫应答。缺乏激光照射时,能观察到完整的健康细胞及球状BPNVs(图b),而激光照射时,胞内细胞器受损严重(图c),同时BPNVs解体成游离的BPQDs。
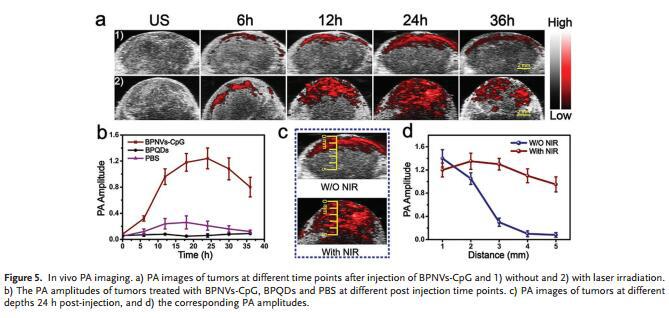
分别对4T1肿瘤模型小鼠进行BPNVs-CpG/激光照射和单独的BPNVs-CpG处理,前者更能增强肿瘤穿透性(图a)。与BPQDs相比,BPNVs-CpG不仅在肿瘤部位更加富集,而且在NIR激光照射时,调控增强肿瘤穿透及按需求释放CpG(图b,c,d)。

与其他实验组相比,BPNVs-CpG/激光照射处理组小鼠表现出最显著的抗肿瘤治疗效果和更高的存活率(图d,e,f,g),从而展现出更强的抗肿瘤生长的光动力免疫疗效。
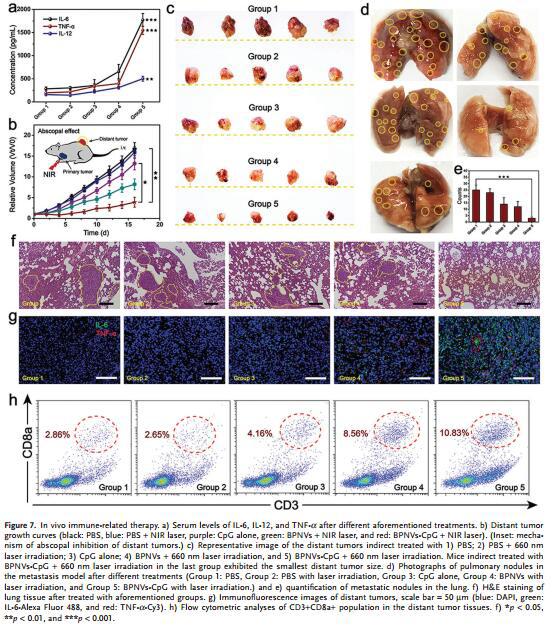
与其他实验组相比,得益于光动力诱导ICD和CpG刺激的协同作用,BPNVs-CpG/激光照射处理组小鼠细胞因子分泌显著提高,表现出最强烈的免疫应答(图a),并能有效抑制远距离肿瘤生长及肺转移(c,d,e,f),同时增强远位肿瘤组织的免疫应答(图g,h)。
文章创新点:
- 本研究通过开发制备一种新型的BPNVs-CpG聚合物,验证了其在抗肿瘤免疫治疗的实用性和有效性,极大地解决了BPQDs在抗肿瘤治疗应用中的局限性问题,为新型抗肿瘤免疫治疗提供新的思路。
- BPNVs-CpG聚合物在NIR激光照射的条件下,不仅能引发癌细胞大量凋亡,并能解离成BPQDs,增强肿瘤穿透性,强化PA成像及抑制肿瘤生长。此外,解离释放的CpG作为强有效的免疫佐剂,协同光动力诱导ICD效应,激发强烈的抗肿瘤免疫应答,并极大地抑制远位肿瘤生长及肺转移。
更多信息获取:
文献链接:https://doi.org/10.1002/adfm.201905758
本文使用的Elabscience产品:
小鼠白介素6(IL-6)酶联免疫吸附测定试剂盒(E-EL-M0044)
小鼠肿瘤坏死因子α(TNF-α)酶联免疫吸附测定试剂盒(E-EL-M3063)
小鼠白介素12(IL-12)酶联免疫吸附测定试剂盒(E-EL-M3062)






