人外周血调节性T细胞鉴定方案
Source: Elabscience®Published: 2022-04-07
CD127 VS Foxp3
虽然Foxp3是目前公认的调节性T细胞最特异的指标,但因其位于细胞内,使得Foxp3的染色必须要固定细胞并破核膜,因此这种方法并不适用于分离活的Tregs,且该方法比较传统,操作相对复杂,稍有不慎就会影响实验结果。
而CD127属于细胞表面Marker,无需固定破膜。因此,当前主流方向是通过CD127来检测人Tregs。
CD127的发现
CD127是2006年被发现的一种检测CD4+CD25+调节性T细胞的新指标。由于不需要将细胞固定破膜处理,检测起来要比Foxp3方便。
研究发现,CD4+CD25+纯化的细胞中,CD127与Foxp3的表达呈负相关。通过CD4+CD127low纯化出的CD4+CD25+ T细胞,与Foxp3纯化的CD4+CD25+ T细胞数量相似,并且这部分细胞展现了CD4+CD25+调节性T细胞的典型特征。CD4+CD25+CD127-/low是较CD4+CD25+Foxp3+更优的特异性检测Tregs的表面标记分子。
配色方案
|
细胞亚群 |
种属 |
指标 | 荧光标记 | 克隆号 |
|
Treg |
Human |
CD45 |
Elab Fluor® Violet 450 |
HI30 |
|
CD3 |
Elab Fluor® Red 780 |
OKT3 |
||
|
CD4 |
FITC |
RPA-T4 |
||
|
CD8a |
PerCP/Cyanine5.5 |
OKT-8 |
||
|
CD25 |
PE |
BC96 |
||
|
CD127 |
Elab Fluor® 647 |
A019D5 |
人Treg鉴定所需流式抗体
|
产品名称 |
荧光素 |
货号 | 规格 |
|
Elab Fluor® Violet 450 |
20T |
||
|
Elab Fluor® Red 780 |
20T |
||
|
FITC |
20T |
||
|
PerCP/Cyanine5.5 |
20T |
||
|
PE |
20T |
||
|
Elab Fluor® 647 |
20T |
人Treg鉴定所需辅助试剂
|
作用 |
货号 |
名称 | 规格 |
|
Cell Staining Buffer |
100mL |
||
|
10×ACK Lysis Buffer |
100mL |
样本管设置
|
目的 |
样本 |
设置 |
|
调电压 |
1 |
Blank(空白管) |
|
调补偿 |
2 |
CD45-Elab Fluor® Violet 450 |
|
3 |
CD3-Elab Fluor® Red 780 |
|
|
4 |
CD4-FITC |
|
|
5 |
CD8a-PerCP/Cyanine5.5 |
|
|
6 |
CD25-PE |
|
|
7 |
CD127-Elab Fluor® 647 |
|
|
Full Panel |
8 |
CD45-Elab Fluor® Violet 450、CD3-Elab Fluor® Red 780、CD4-FITC、CD8a-PerCP/Cyanine5.5、CD25-PE、CD127-Elab Fluor® 647 |
实验步骤
01. 在离心管内加入100μL新鲜血,与2mL 1×ACK红细胞裂解液混匀,4℃裂解10min;
02. 300g离心5min(裂解完立即离心,防止时间过长损伤细胞),弃掉上清,用移液枪轻轻吸走残液,可以得到白色的细胞沉淀;
03. 加入100μL细胞染色缓冲液,重悬细胞,与流式抗体混匀,4℃孵育30min;
04. 加入2mL细胞染色缓冲液,300g离心5min,弃掉上清,再加入200μL细胞染色缓冲液,重悬细胞;
05. 上机进行检测。
实验结果
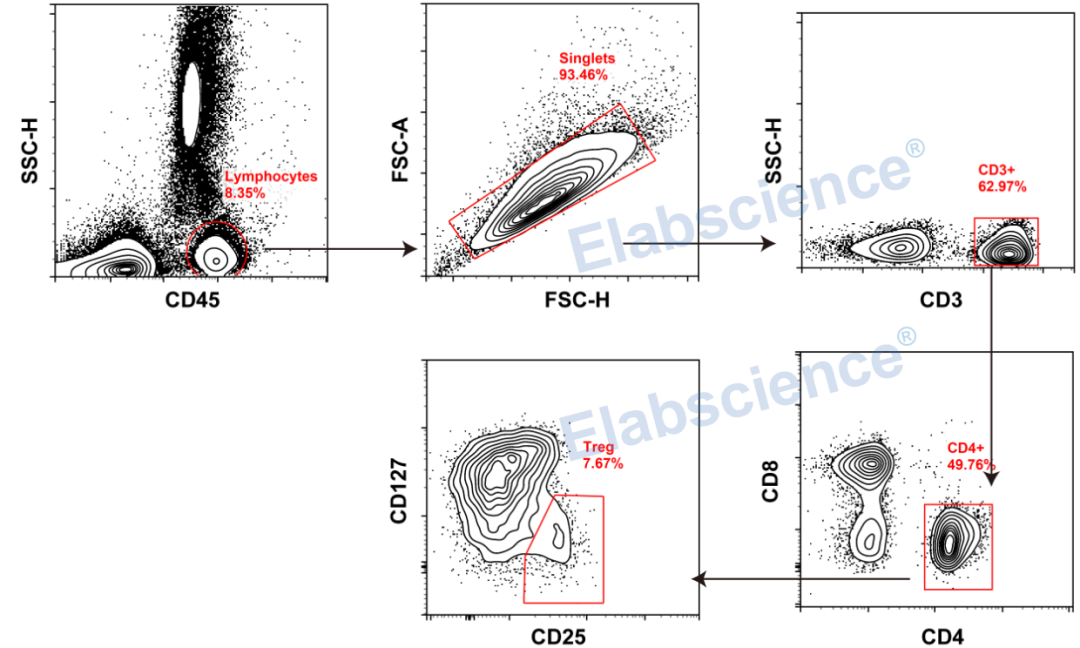
人外周血Treg细胞表型分析
解析:
▶ 荧光素间有溢漏,故需要设置单阳管,用于调节补偿;
▶ 本实验取正常人外周血验证,无生物学对照;
▶ 增加CD45指标,便于淋巴细胞圈门;
▶ 圈门路径:
第一步,根据CD45和SSC-H,圈出淋巴细胞群;
第二步,利用FSC-H和SSC-H,去黏连,得到单细胞;
第三步,通过CD3,确定CD3+ T细胞;
第四步,通过CD4和CD8,得到CD4+辅助T细胞;
第五步,通过CD25+CD127-/low,确定出Treg细胞亚群。
相关阅读: 流式课堂 | 小鼠调节性T细胞鉴定方案






