文献速递 | 抑制mTORC1通路或许会成为骨关节炎最有前景的治疗方法
Source: Elabscience®Published: 2019-07-08
题目:Activation of mTORC1 in subchondral bone preosteoblasts promotes osteoarthritis by stimulating bone sclerosis and secretion of CXCL12
期刊:Bone Research
物种:Mouse
Elabscience产品:Mouse (SDF1) ELISA Kit

“We used the mouse (SDF1) ELISA (enzyme-linkedimmunosorbent assay) Kit (Elabscience Biotechnology Co. Ltd, Wuhan, China;#E-EL-M3046) to analyze Cxcl12 in serum and CM.ELISA analysis was performed according to the manufacturer’s instructions.”
▶文献速递
越来越多的证据表明,骨关节炎(OA)的发展离不开软骨下骨的病变过程。但是,软骨下骨的形成和软骨下骨促进骨关节炎形成的机制尚不清楚。
在这篇文章中讲述了,在OA患者和小鼠中,软骨下骨骨膜前细胞(Osterix +)的mTORC1通路是被激活的。如果删除上游的mTORC1抑制剂(tuberous sclerosis 1),Osterix +的mTORC1通路就会被激活,从而诱导异常软骨下骨形成;软骨下骨硬化对关节软骨完整性几乎没有影响,但是会加速创伤后的小鼠OA的形成。相反,通过破坏Raptor (mTORC1-特异组分)来抑制Osterix +的mTORC1通路,就可以减少软骨下骨形成和软骨退化;同时这也减缓了轻创伤后小鼠OA的形成过程。
研究机制表明,mTORC1的激活会促进Osterix +的增殖和CXCL12的分泌,最终导致软骨下骨形成和软骨退化形成OA。而CXCL12可以激活免疫抗体从而有效地减少软骨退化减轻小鼠OA病症。
总之,Osterix +的mTORC1通路被激活不足以导致OA,但是关节术后手术越不稳定,就越容易诱导软骨下骨的重塑和CXCL12分泌从而加速了OA形成的过程。通过药物抑制mTORC1通路,来治疗OA是一种有希望的治疗方法。
▶实验结果及分析
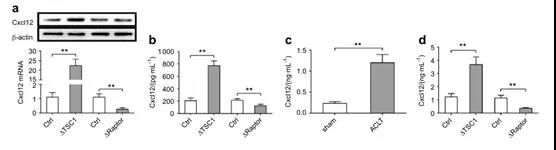
Osterix +中的mTORC1激活后会分泌CXCL12,从而促进软骨降解。为了探索Osterix +中mTORC1促进OA发展的机制,作者使用微阵列创建了一个tsc1缺陷或正常的Osterix +的全球mRNA表达谱。
在所有上调的mRNA中,CXCL12已被报道在软骨退化中发挥重要作用。作者发现CXCL12在体外Osterix +中有确定的表达(Fig. 5a),并进一步证实,相比对照组细胞,CXCL12 mRNA在ΔTSC1的Osterix + 有超过20倍的增加,而反在ΔRaptor组有超过5倍的降低 (Fig. 5a)。体外培养的Osterix +中Cxcl12蛋白表达也有类似的变化,和对照组比,在ΔTSC1细胞上清中CXCL12的分泌是正向调节的表达,同时在ΔRaptor细胞上清中是负向节的(Fig. 5b);野生型小鼠经过ACLT手术后,血清CXCL12水平会明显增高(Fig. 5c);ΔTSC1老鼠在ACLT手术后血清Cxcl12会更加显著地在增高,相反ΔRaptor老鼠血清CXCL12会有显著降低 (Fig.5d)。
这些发现表明,mTORC1能积极调节Osterix +中CXCL12的表达和分泌,由于Osterix +中mTORC1的表达而导致CXCL12的水平变化,进而呈现ΔTSC1和ΔTSC1 ACLT小鼠中关节软骨的退化。
▶文献总结
研究结果显示软骨下骨-关节软骨的相互作用是OA发展的一种新的病理机制。Osterix +中mTORC1的激活促进OA的形成,mTORC1激活后会促进前成Osterix +的增殖并大量分泌CXCL12,进而导致异常软骨下骨重建、骨硬化、关节软骨变性等。因此,通过药物抑制mTORC1通路可能对OA患者的治疗有很大的作用。
▶文献涉及的产品信息
货号:E-EL-M3046
名称:Mouse SDF-1/CXCL12(Stromal Cell Derived Factor 1) ELISA Kit






