细胞死亡大盘点—铜死亡
Source: Elabscience®Published: 2023-12-25
在上一期的细胞死亡大盘点中,分享过铁死亡的相关知识,那么除铁死亡之外,还有其他与金属元素有关的死亡方式吗?今天我们来介绍另一种与金属元素相关的细胞死亡方式——铜死亡(Cuproptosis)。

铜死亡首次提出于2022年《Science》期刊刊登的论文“Copper induces cell death by targeting lipoylated TCA cycle proteins” ,铜与三羧酸(TCA)循环的脂酰化成分直接结合,导致了脂酰化蛋白质聚集和铁硫簇蛋白质丢失,进而引发蛋白质毒性应激,并最终致使细胞死亡。
01 铜死亡的调控
作为一种新发现的细胞死亡方式,已发现有些铜死亡的调控涉及铜代谢、线粒体功能及蛋白质修饰。其中FDX1和DLAT蛋白质脂酰化,是诱导铜死亡的关键因子。过量的铜促进了脂酰化蛋白的聚集和功能缺失,引发铁硫簇蛋白的不稳定,导致蛋白质毒性应激,并最终致使细胞死亡。
其他关于铜死亡的研究主要是依托生物信息学开展,通过TCGA等数据库的信息和生物信息学分析,筛选出与铜死亡相关的基因及可能存在的调控通路,并预测其与疾病间的关系。例如乳腺癌、急性髓性白血病、糖尿病研究中发现铜死亡相关基因SLC31A1、DLAT、ATP7A和ATP7B的表达会发生显著变化。关于铜死亡的调控和不同病理背景下铜死亡的相关调控通路有待后续进一步的研究。
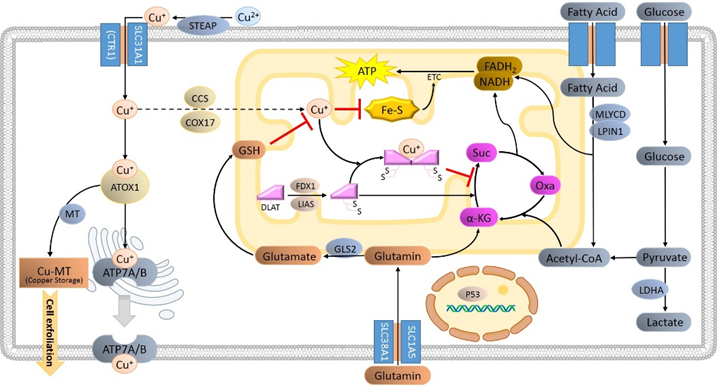
图1. 铜代谢和铜死亡相关的调控通路
02 铜死亡的特点
铜死亡是一种发生机制明显区别于已知的细胞凋亡、焦亡、坏死性凋亡及铁死亡的受控性细胞死亡方式,主要特征是细胞铜含量的增加,其诱导的死亡可以被铜离子载体诱导和铜螯合剂抑制,但不能被其他细胞死亡抑制剂抑制。
表1. 不同细胞死亡方式特征对比
|
方式 |
形态特征 |
生物学特征 |
发生影响 |
|
铜死亡 |
线粒体膜破裂 |
铜、丙酮酸、α、酮戊二酸、HSP70升高;Fe-S减少 |
引发免疫响应 |
|
铁死亡 |
线粒体皱缩,嵴减少,外模破裂 |
亚铁和脂质过氧化积累;Cystine摄入降低 |
引发免疫响应 |
|
凋亡 |
细胞皱缩、脱离;核结构消失,DNA均匀降解;形成凋亡小体 |
细胞色素C释放Caspase;细胞内钙离子升高;线粒体膜电位降低 |
单个细胞不同步丢失;不引发炎症 |
|
自噬 |
形成自噬溶酶体;细胞内形成空泡 |
LC3-II/LC3-I比例升高 |
单个细胞不同步发生;维持组织稳态 |
|
焦亡 |
细胞膨大变形;细胞器变形;细胞核固缩 |
Gasdermin-D切割并激活;释放促炎症因子 |
引发炎症反应 |
03 铜死亡的检测
铜死亡的判断与检测,可以通过四个方面进行检测:相关基因检测,相关蛋白检测,细胞形态检测,代谢检测。这些检测指标包括各个调控途径的关键基因及特征指标。
细胞形态检测:检测线粒体的形态变化和细胞膜的完整性。
相关基因的检测:如FDX1、LIAS、SLC31A1。
相关蛋白的检测:如DLAT、Fe-S、HSP70。
相关代谢的检测:如细胞活性的变化;铜离子的细胞内指标变化,如OCR、αC酮戊二酸、丙酮酸等。

图2. 铜死亡研究中细胞铜的检测(引用产品E-BC-K775-M)
Elabscience®铜死亡检测试剂
点击货号查看产品详情
|
产品名称 |
货号 |
|
还原型谷胱甘肽(GSH)比色法测试盒 |
E-BC-K030-M |
|
总谷胱甘肽(T-GSH)/氧化型谷胱甘肽(GSSG)比色法测试盒 |
E-BC-K097-M |
|
丙酮酸比色法测试盒 |
E-BC-K130-M |
|
乳酸脱氢酶(LDH)细胞毒性比色法测试盒 |
E-BC-K771-M |
|
NADP+/NADPH 比色法试剂盒(WST-8法) |
E-BC-K803-M |
|
谷氨酰胺(Gln)比色法测试盒 |
E-BC-K853-M |
|
线粒体呼吸链复合物II比色法测试盒 |
E-BC-K150-M |
|
线粒体呼吸链复合物Ⅳ(细胞色素c氧化酶)比色法测试盒 |
E-BC-K152-M |
|
细胞铜(Cu)比色法测试盒(络合法) |
E-BC-K775-M |
|
线粒体呼吸链复合物I(NADH-辅酶Q还原酶)比色法测试盒 |
E-BC-K149-M |
|
线粒体呼吸链复合物Ⅲ(辅酶Q-细胞色素C还原酶)比色法测试盒 |
E-BC-K151-M |
|
线粒体呼吸链复合物Ⅴ(F0F1-ATP酶/ATP合成酶)比色法测试盒 |
E-BC-K153-M |
|
α-酮戊二酸(α-KG)荧光法测试盒 |
E-BC-F047 |
|
增强型细胞活力检测试剂盒(CCK-8) |
E-CK-A362 |
本期关于铜死亡的介绍就到这里了,下期我们将给大家带来双硫死亡的介绍,欢迎关注哦~
相关阅读






